Materia
Se define como aquello que tiene masa, ocupa un espacio, posee una cierta cantidad de energía y está compuesto de átomos y moléculas, que son, a su vez, materia.
La materia se encuentra en todas partes y en cualquier estado físico (sólido, líquido, gaseoso, plasma).Si la materia tiene masa y ocupa un lugar en el espacio significa que es cuantificable, es decir, que se puede medir.
¿QUE FORMA LA MATERIA?
Químicamente la materia esta formada por partículas microscópicas, que llamamos atomos. Los átomos constituyen las unidades fundamentales de la materia y contiene tres tipos de partículas:
Electrones (carga negativa), protones (carga positiva) y neutrones (carga neutra). Los protones y neutrones están en el núcleo atómico, y los electrones en torno a él.
PROPIEDADES DE LA MATERIA
Las propiedades de la materia se dividen en generales (comunes a cualquier tipo de materia) y específicas (Propiedades intrínsecas que permiten diferenciar un cuerpo de otro).
PROPIEDADES GENERALESLas propiedades generales de la materia son aquellas propiedades en común que tienen todos los cuerpos y nos permiten diferenciar una sustancia de otra.
1. MasaEs la cantidad de materia que posee un cuerpo; es constante para los materiales. Su unidad de medida es el kilogramo. Otras unidades de medida para la masa son los gramos (g), las libras (lb), las arrobas (@) y las toneladas (t). Su instrumento de medida es la balanza.

2. Peso: Es la medida que cuantifica la fuerza de atracción de la gravedad, sobre la masa de un cuerpo. Su unidad de medida es el Newton (N), otras unidades son dina (d) y Kilogramo-fuerza (kgf). El instrumento de medida es el dinamómetro.
3. VolumenEs el espacio que ocupa un cuerpo; sus unidades de medida son el metro cubico (m3) y el litro (l) utilizado en líquidos, otras unidades son las onzas, barriles y galones.
 4. Inercia: La resistencia que opone la materia a modificar su estado de reposo o movimiento.
4. Inercia: La resistencia que opone la materia a modificar su estado de reposo o movimiento.
5.ImpenetrabilidadUn cuerpo no puede ocupar el mismo espacio de otro al mismo tiempo

6. Porosidad. Espacio que existe entre las partículas de un cuerpo.
7. Divisibilidad. Capacidad de subdivisión en partes más pequeñas de la materia.
PROPIEDADES ESPECÍFICAS O INTRÍNSECAS DE LA MATERIA
Son propias de cada material y permiten caracterizarlos, identificarlos y diferenciarlos de otros. Dependen del estado en el que se encuentra el material, sin importar la cantidad del mismo. Estas propiedades pueden ser físicas y químicas.
- Propiedades físicas
Son las que se pueden determinar sin que los cuerpos varíen su naturaleza. Entre las propiedades físicas se encuentran:
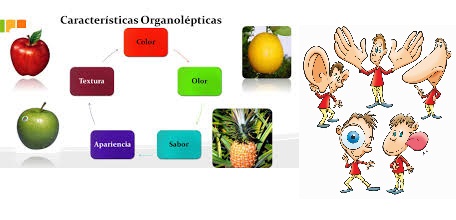
- Propiedades organolépticas:
Son aquellas que se determinan a través de las sensaciones percibidas por los órganos de los sentidos. Por ejemplo, el color, el olor, el sabor, el sonido y la textura.
Es la propiedad de la materia que se origina por el grado de cohesión de las moléculas. La me nor o mayor movilidad de las moléculas caracteriza cada estado. Aunque tradicionalmente estamos acostumbrados a referirnos a tres estados de la materia: solido, líquido y gaseoso; investigaciones recientes proponen la existencia de otros estados, los cuales se producen, sobre todo, en condiciones extremas de temperatura y presión. Estos nuevos corresponden al estado de plasma y el superfluido.

Relación numérica entre masa y volumen. Las unidades en que se expresa son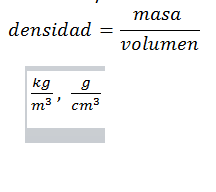
Es la temperatura a la cual una sustancia pasa del estado líquido al estado gaseoso, su valor es diferente a cada sustancia. Por ejemplo, el punto de ebullición del agua es de 100° C al nivel del mar, ninguna otra sustancia ebulle a esa temperatura.

Es la temperatura a la cual una sustancia pasa del estado sólido al estado líquido. Por ejemplo, el agua pasa de estado sólido al estado líquido a 0°y el hierro a 1539°. Con el punto de fusión se puede determinar si una sustancia es pura o es una mezcla, ya que varía si la sustancia esta mezclada con otra.
 Mide la capacidad que tienen ciertos materiales para convertirse en láminas, como el cobre o el aluminio.
Mide la capacidad que tienen ciertos materiales para convertirse en láminas, como el cobre o el aluminio.

Es la propiedad que tienen algunas sustancias de disolverse en un determinado medio a una temperatura determinada.

Mide el grado de facilidad con que ciertos materiales se dejan convertir en alambres o hilos.

Es la resistencia que oponen a ser rayadas. Se mide mediante una escala denominada escala de Mohs que va de uno hasta diez.

Es la capacidad que tienen algunos materiales de conducir el calor y/o la electricidad.

Es la resistencia que ofrecen los cuerpos a romperse o deformarse cuando se les golpea. Uno de los materiales mas tenaces es el acero.
Elasticidad:
Propiedad mecánica de ciertos materiales de sufrir deformaciones reversibles cuando se encuentran sujetos a la acción de fuerzas exteriores y de recuperar la forma original si estas fuerzas exteriores se eliminan.
Fragilidad:
Es la tendencia que tienen algunos materiales a romperse o fracturarse, como el vudrio.
2.PROPOEDADES QUIMICAS
Las propiedades quimicas de una sustancia se relacionan con la composicion de la misma y la capacidad de esta para reaccionae frente a otras y producir nuevas sustancias con propiedades diferentes.
Algunas de las propiedades químicas son:
Es un proceso de algunas sustancias como los metales que al entrar en contacto directo con el oxígeno del aire o del agua, reaccionan para formar otra sustancia llamada oxido.

Es el proceso mediante el cual una sustancia arde en presencia de oxígeno.

Es la medida de la facilidad que presenta una sustancia para encender y de la rapidez con que se dispersan las llamas producidas, una vez encendida.

Es la propiedad que presentan algunas sustancias de combinarse, para transformarse en otras con características diferentes.

Es la capacidad que tienen algunas sustancias de producir daños o lesiones en los tejidos vivos.

CLASIFICACION DE LA MATERIA
Existen muchas formas y criterios para clasificar la materia. Desde un punto de vista general, podemos enumerar los principales del siguiente modo:
- Materia viviente. Conforma a los seres vivos, mientras estén vivos.
- Materia inanimada. Compone los objetos inertes, sin vida, o muertos.
- Materia orgánica Formada principalmente por átomos de carbono e hidrógeno, y generalmente está vinculada con la quimica de la vida
- Materia imorgánica. No es orgánica y no tiene que ver necesariamente con la vida sino con reacciones químicas espontáneas o no espontáneas.
- Materia simple. Está compuesta por átomos de pocos tipos diferentes, o sea, está más cerca de la pureza.
- Materia compuesta. Se compone de numerosos elementos de diverso tipo, alcanzando niveles de complejidad elevados.
ESTADOS DE LA MATERIA
Los estados de la materia se refieren a la forma como se organizan las moléculas constituyentes de la misma. También se conocen como estados de agregación de la materia.Existen cinco estados de la materia: sólido, líquido, gas, plasma y condensado Bose-Einstein.
Un sólido tiene una forma y volumen definido, ya que sus moléculas están empacadas estrechamente, lo cual limita el movimiento entre ellas.
Un líquido tiene un volumen definido y adquiere la forma del recipiente en el que está contenido. Las moléculas de los líquidos se agrupan de forma tal que pueden moverse con mayor libertad, comparadas con los sólidos.
Ejemplos de estado líquido a temperatura ambiente son el agua, el mercurio, el aceite y el alcohol.
En los gases, las moléculas o átomos se encuentran dispersos en el espacio que los limita. No tienen volumen ni forma definida, es decir, adquieren la forma y el volumen del recipiente donde están contenidos.
Ejemplos de gases a temperatura ambiente los tenemos en el aire, que es una mezcla de elementos gaseosos como el oxígeno, el nitrógeno y el dióxido de carbono.
El plasma se produce cuando un gas recibe una gran cantidad de energía, lo que provoca la liberación de sus electrones. Como los gases, el plasma no tiene ni forma ni volumen definido.
Ejemplos de plasma los conseguimos en las estrellas, los rayos, las luces fluorescentes y las señales de neón.Un estado condensado Bose-Einstein se logra cuando un grupo de átomos se enfría hasta casi el cero absoluto (-273 ºC). En este punto, los átomos prácticamente no se mueven entre sí, comportándose como si fueran un solo átomo.
Ejemplos de estado condensado de Bose-Einstein apenas se consiguieron de forma experimental en los años 90 del siglo XX. Muchos de estos experimentos usan átomos de rubidio enfriados con láser.

 4. Inercia: La resistencia que opone la materia a modificar su estado de reposo o movimiento.
4. Inercia: La resistencia que opone la materia a modificar su estado de reposo o movimiento.





















No hay comentarios:
Publicar un comentario
Nota: solo los miembros de este blog pueden publicar comentarios.